[경도]
기출 유형
|
1. 물의 경도, 유발물질
2. 경도 제거법
|
키워드
|
알칼리도, 경도 유발물질, Sclae유발, 2가양이온
|
대제목
|
1. 개요(정의)
2. 측정방법
3. 경도기준/특징
4. 수처리 활용
|
Tip
|
경도 자체는 1교시 문제로 출제됨
|
이론
1. 정의
경도(또는 전경도:Total Hardness)라 함은 물속에 용해되어 있는 Ca2+, Mg2+등의 2가 양이온 금속이온에 의하여 발생하며 이에 대응하는 CaCO3(ppm)으로 환산표시한 값으로 물의 세기를 나타낸다.
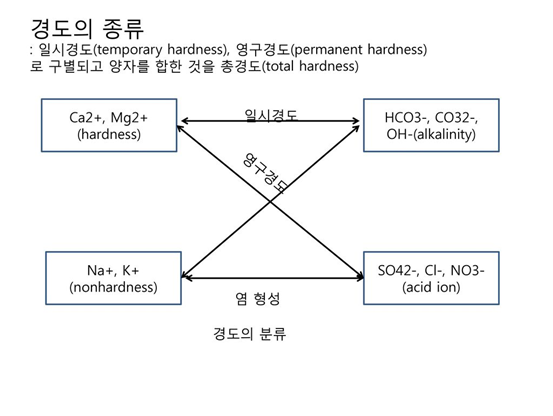
경도에는 일시 경도(temporary hardnes)와 영구 경도(permanent hardness)로 구별되고 양자를 합한 것을 총경도(Total hardness)라 한다
물의 경도는 주로 토양과 암석층을 통과한 물에서 얻어지게 되는데 박테리아의 작용으로 발생한 CO2 용해되어 생긴 낮은 pH의 토양수는 염기성물질인 석회암등을 용해시키고 석회암 속의 탄산염, 황산염, 규산염등을 포함시키게 된다. 그러하여 일반적으로 지표수보다 지하수의 경도가 높다.
2. 측정방법
가. EDTA 적정법 (Ca,Mg 이온 측정, 신속하게 측정 가능)
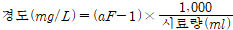
a : 적정에 소비된 EDTA 용액의 부피(ml)
F : EDTA용액(0.01M)의 농도계수
나. 당량 계산법
경도(CaCO3mg/l) = (M2+mg/l) * 50/(M2+당량)
3. 경도의 종류
가. 영구경도 (SO4^- > Cl^- > NO3^- > SiO3^2- + 2가 양이온 결합)
칼슘염이나 마그네슘염, 철염등을 포함하고 있는 물을 경수라고 하며 끓이는 것으로는 연화되지 않는 경우의 물을 영구경수라 한다. 즉 황산염이나 염화물은 끓여도 분해되지 않고 침전되지 않아 경도에 변화가 오지 않으며 이러한 경우를 영구경도라 한다.
나. 일시경도 (Ca^2+, Mg^2+, Fe^2+, Mn^2+, Sr^2+ + 알칼리도 유발물질)
물속에 칼슘과 마그네슘을 주성분으로 하는 중탄산칼슘, 중탄산마그네슘과 같은 중탄산염이 존재하고, 중탄산염을 포함한 물을 끓이면 중탄산염은 분해하여 탄산염으로 되어 가라앉으므로 물의 경도는 작아지고 연화된다. 이렇게 끓이는 것으로 경도가 감소되는 것을 일시경도라 한다.
다. 가경도 (Na^+ > K^+)
나트륨이 고농도로 함유하고 있어 발생하는 경도와 유사한 현상
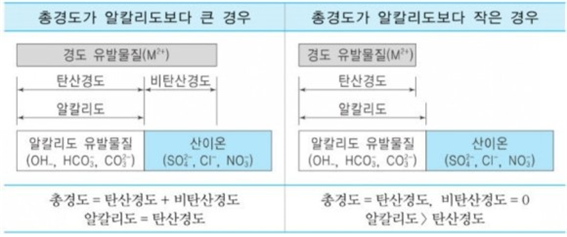
총경도 = 탄산경도 + 비탄산경도
1) 총경도 > 알칼리도 = 알칼리도는 → 탄산경도
2) 총경도 < 알칼리도 = 총경도 → 탄산경도
4. 경도기준
가. 경도에 따른 분류
|
구분
|
연수
|
적당한 경수
|
경수
|
고경수
|
|
세기
|
75이하
|
75~150
|
150~300
|
300이상
|
* 먹는물 수질기준 : 경도 300mg/L이하(샘물은 제외)
5. 제거방법
|
제거방법
|
원리
|
특징
|
|
자비법
|
물을 끓여 일시경도제거
|
에너지 소모량 과다
|
|
정석연화법
|
수중의 칼슘을 탄산칼슘으로 유동매체에 정석시켜 제거(pH10)
|
슬러지 처리 불필요
알칼리도 소모
pH조정시설 필요
유동매체 정기적 배출, 보충 필요
|
|
석회소다법
|
소석회, 소다회, 가성소다 첨가
Mg(OH)₂, CaCO₃ 형태로 침전제거
|
탁질, 중금속 동시제거 가능
약품비 과다
|
|
이온교환법
|
수중의 경도성분 이온을 이온교환수지로 Na+이온과 교환제거
|
모든경도 물질 제거 가능
고탁도 물에 적용 곤란
고 Na+ 함유시 적용 어려움
초기투자비 큼
|
경도 제거 방법
○자비법
1) 원리 : 물을 끓여 탄산경도 제거
2) 특징 : 에너지 소비 과다
○정석연화법
1) 원리 : NaOH로 pH를 약 10으로 조절하여 수중에 칼슘을 정석칼슘으로 정석시켜 제거
2) 장점 : 슬러지 처리 불필요
단점 : Mg이온제거불가(Ca만 가능), 알칼리도 소모, 유동매체 정기적배출로 보충 필요
○응석침전법
1)원리 : 소석회, 소다회,NaOH 첨가 → Mg(OH)2, CaCO3형태로 침전 및 제거
탄산경도
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 ↓ + 2H2O
Mg(HCO3)2 + 2Ca(OH)2 → Mg(OH)2 ↓ + 2CaCO3 ↓ + 2H2O
비탄산경도
Mg[Cl2, SO4] + Ca(OH)2 → Mg(OH)2 ↓ + Ca[Cl2,SO4]
Ca[Cl2.SO4] + NaCO3 → CaCO3 ↓ + Na[Cl2.SO4]
2) 장점: 초기 투자비 적음, 탁질, 중금속이온 동시제거 가능
단점 : 약품비 과다(pH11 정도 증가 필요), 슬러지 발생
○이온교환법
1)원리 : 수중의 경도성분 이온을 이온교환수지로 Na^+ 이온과 교화,제거
2) 장점 : 모든 경도물질 제거 가능, pH저하 없음, 설치부지작고 슬러지 발생없음
단점 : 고탁도 물에 적용불가, 해수와 같이 Na^+ 다량인 물에 적용불가, 초기 투자비용 큼
6. 경도에 의한 영향
가. 고경수 음용시 설사 유발(300mg/L이상)
나. 보일러, 수도관 스케일유발
다. 세제 사용량, 응집제 사용량 증가