[암모니아 탈기법]
○기출문제
암모니아 탈기법
물리화학절 질소제거방법
암모니아 탈기법(Ammonia stripping)
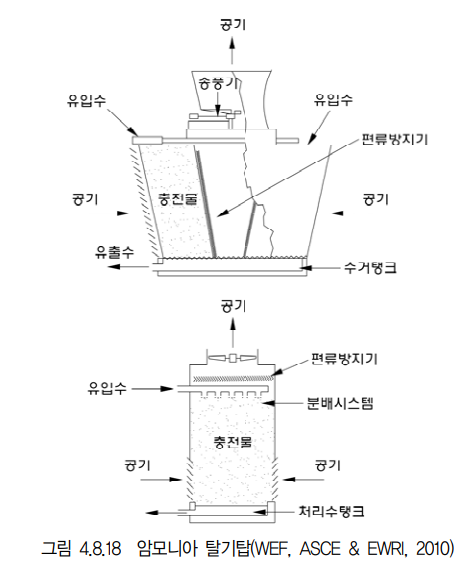
- 개요
암모니아스트리핑이란 암모니아의 물리화학적 제거법의 일종으로 알칼리제를 주입하여 pH를 11이상으로 상승시킨후 Blower를 이용하여 공기를 불어주면 암모니아가 질소로 환원되어 제거되는 방식이다.
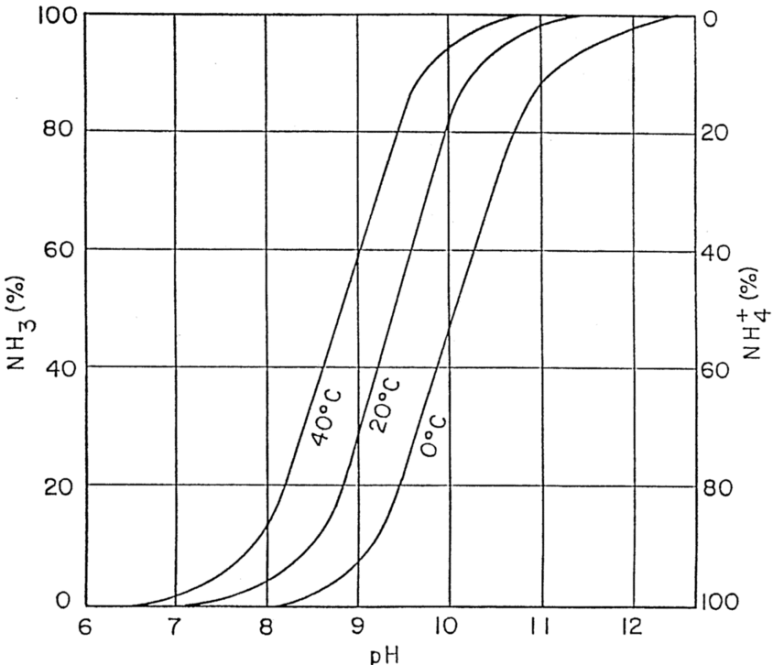
암모니아는 수중에서 pH에 따라 NH3 또는 NH4^+로 존재하게되는데 pH를 11이상으로 올려주면 대부분이 NH3-N로 존재하게되는 암모니아의 특성을 이용한것이다.
해당 공법은 수온과 pH에 따라 효율에 영향을 받으므로 적절한 범위를 유지해주어야 하며 응집침전법과 병행시 질소와 인을 동시제거할수 있다는 장점이 있으나 pH의 알칼리성을 유지하기위한 약품비용과 제거과정에서 발생되는 암모니아의 후처리가 요구된다.
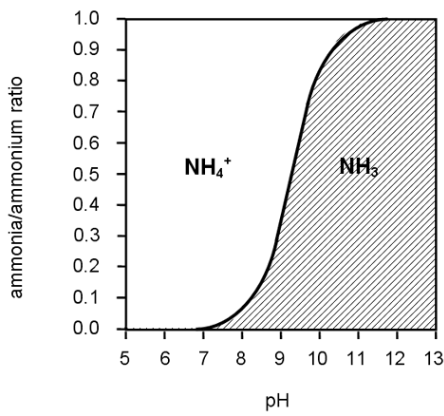
pH에 따른 NH3 , NH4의 비율 / 출처 https://blog.naver.com/msluv1202/30133706883
1-2. 반응식
NH₃+H₂O ↔ NH₄⁺ + OH ⁻
pH증가시 NH4에서 NH3로 역반응이 일어난다.
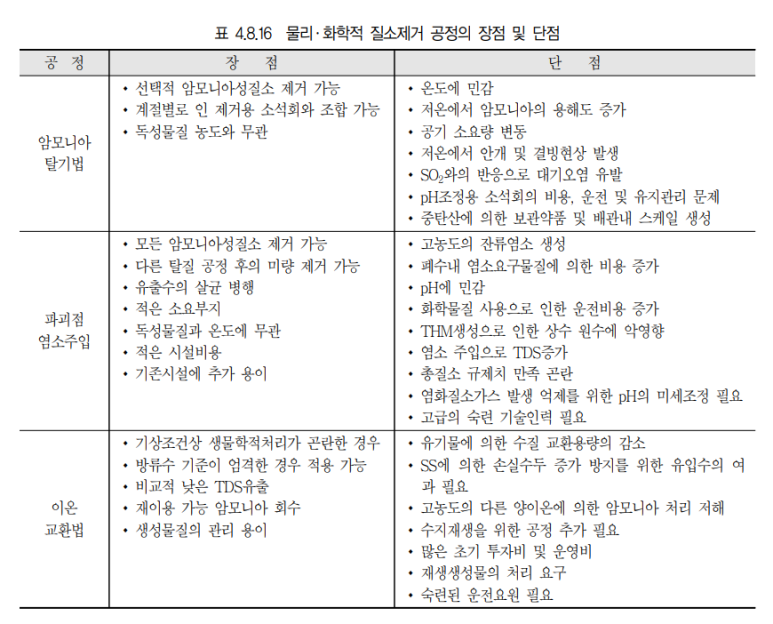
2. 장단점
1) 장점
(1) 생물학적 질소처리에 비하여 운영비와 소요면적 절감이 가능하다.
(2) 응집침전과 병행하면 질소와 인을 동시처리가 가능하다.
(3) 암모니아를 신속하게 처리할수 있다.
(4) 운전,유지관리가 용이하다.
2) 단점
(1) 암모니아성 질소만 처리가 가능하다.
(2) 다량의 공기숭풍량 요구로 과도한 Blower 동력비가 발생한다.
(3) 소음, 악취문제가 발생한다.
(4) pH유지를 위한 과도한 약품비용이 발생한다.
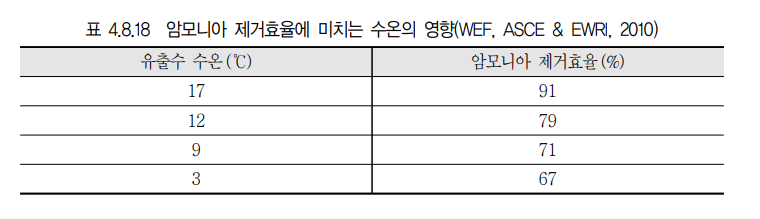
(5) 동절기에는 수온저하에 따른 NH3용해도가 높아져 제거효율이 떨어진다.
(6) 탈기된 유출수의 pH 중성화가 필요하다.
(7) 공정중 발생하는 암모니아의 후처리가 필요하다.
(8) 탈기법 단일공정만으로는 제거효율의 한계가 있다.
(9) 칼슘이온이 CO2와 반응하여 탄산칼슘을 생성하고 스케일의 원인이 된다.
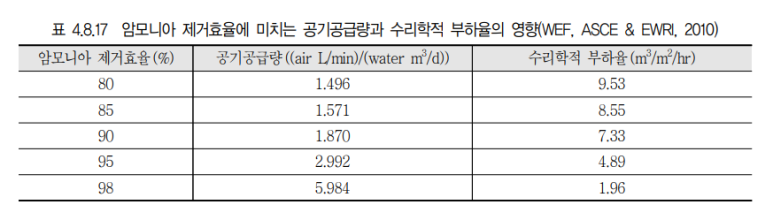
3. 영향인자
1) 온도
고수온에서 제거효율이 가장좋으며 수온이 낮을수록 효율이 떨어진다.
2) pH
pH 11이상에서 제거효율이 가장좋으며 pH가 낮을수록 효율이 떨어진다.
3) 송풍량
송풍량에 따라 암모니아 탈기효율이 달리지며 송풍량이 탈기효율에 비례하지는 않으나 적절한 유량의 공급으로 효율을 증대시켜야함.
물리, 화학적 질소제거 방법
- 암모니아 탈기법(Ammonia stripping)
암모니아는 수중의 pH에 따라 NH3와 NH4+으로 존재하며 pH 11이상에서는 암모니아의 대부분의 형태가 NH3-N로 존재하게된다. 이때 폐수에 Air 공급시 NH3가 N2가스로 신속하게 탈기되어 제거 되는 방식으로 반응식은 다음과 같다.
반응식 : NH3 + H2O <---> NH4^+ + OH^-
pH를 조절하여 pH7이상으로 올리면 반응식에서 오른쪽에서 왼쪽으로 이동하기 시작해 pH11이상에서는 대부분의 암모니아는 NH4^+ > NH3로 변하게 된다.
온도40도씨 pH 11정도에서 가장 높은 효율로 제거된다.
암모니아 스트리핑은 pH 유지에 따른 과도한 약품사용비용과 탈기과정에서 발생하는 암모니아가스의 후속처리가 요구된다.
출처 네이버
2. 파괴점 염소주입법(Break point chlorination)
염소 소독과정에서 수중에 존재하는 암모니아성 질소와는 주입 염소와의 반응으로 제거되는데 반응식은 다음과 같다.
2NH3 + 3Cl2 ↔ N2 + 6HCl
염소주입시 수중의 암모니아와 반응하여 암모니아성 질소는 산화되어 제거되고 암모니아성 질소가 제거된 뒤에는 염소는 유리잔류염소로 생성된다.
암모니아성질소를 함유하고 있는 유입수에 염소를 주입하면, 암모니아성질소는 차아염소산과 반응하 여 클로라민(Chloramine)을 형성한다. 여기서 파괴점(Breakpoint) 후에도 염소를 계속 주입하면 질 소가스로 변환되지만 질소가 산화되기 전에 쉽게 산화되는 유기물질이나 Fe2+, Mn2+, H2S 등을 우 선적으로 산화시켜야 하는 문제점이 있다. 다음 반응식은 암모니아가 염소의 산화로 인하여 질소가 스로 변환되는 것을 나타낸다.
Cl2 + H2O → HOCl
NH4 + + HOCl → NH2Cl + H2O +H+
2NH2Cl + HOCl → N2 + 3HCl + H2O
다양한 클로라민의 형성되는 정도는 pH, 접촉시간, 온도, 반응물의 농도 등에 영향을 받으며, 염소주 입에 의한 암모니아성질소 제거의 전체반응은 다음과 같이 표현된다. 2NH3 + 3Cl2 → N2 + 6HCl 일반적인 파괴점 염소주입 곡선은 그림 4.8.19와 같으며, 파괴점은 암모니아 농도가 0에 가깝게 되 며, 총 잔류염소가 최소가 되고, 유리 잔류염소가 검출되는 곳에서 발생한다. 이론적으로 1mg/L의 암모니아성질소를 질소가스로 산화시키는데 필요한 염소의 양은 7.6mg/L이다.
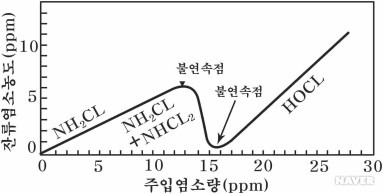
출처 네이버지식백과
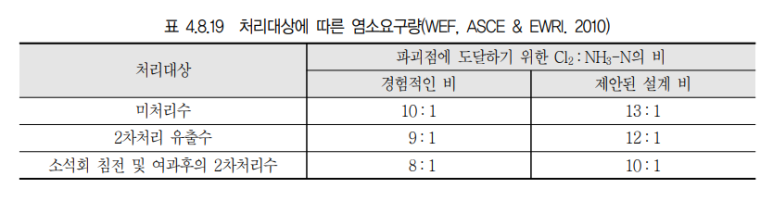
3. 이온교환법
이온교환 공정은 암모니아성질소에 대하여 선택성이 높은 제올라이트 등을 사용하여 암모니아성질소를 제거하 는 공정이다.
이온교환법은 충천탑의 이온수지를 충전하여 처리수와 이온교환을 통해 이온물질을 제거하는 공정으로
교환, 역세, 재생, 세정등의 4단계로 나뉘어져 있고 반응식은 다음과 같다.
NH4^+ + R-Na <--> Na^+ + R-NH4^+
수중의 암모니아가 수지의 이온(R-Na^+)과 양이온 교환반응을 하며 제거되는 원리이다.
질소제어에 있어서 폐수처리공정에서 일반적으로 제거되는 이온은 암모늄이온(NH4 + )과 질산성질소 이온(NO3 - )이다. 암모늄이온과 치환되는 이온은 상을 재생하기 위하여 사용되어진 용액의 성질에 따 라 변화한다. 천연 혹은 합성 이온교환 수지가 이용되지만 내구성 때문에 합성수지가 널리 이용된다. 하․폐수에서 몇 개의 천연수지(Zeolite)가 암모니아 제거에 사용되어지며 천연 제올라이트에서는 clinoptilolite가 천연 교환수지 중에서 가장 효과적이다. 제올라이트는 다른 교환수지보다 암모늄이 온에 대한 친화력이 크고 합성수지에 비하여 가격이 저렴하다. 제올라이트를 이용한 이온교환 공정 은 기후의 영향이 적고, 암모니아 제거효율이 약 90~95%로 높게 나타나지만 질산성질소, 아질산성 질소 및 기타 유기성질소는 제거되지 않으며 전처리가 필요하다.
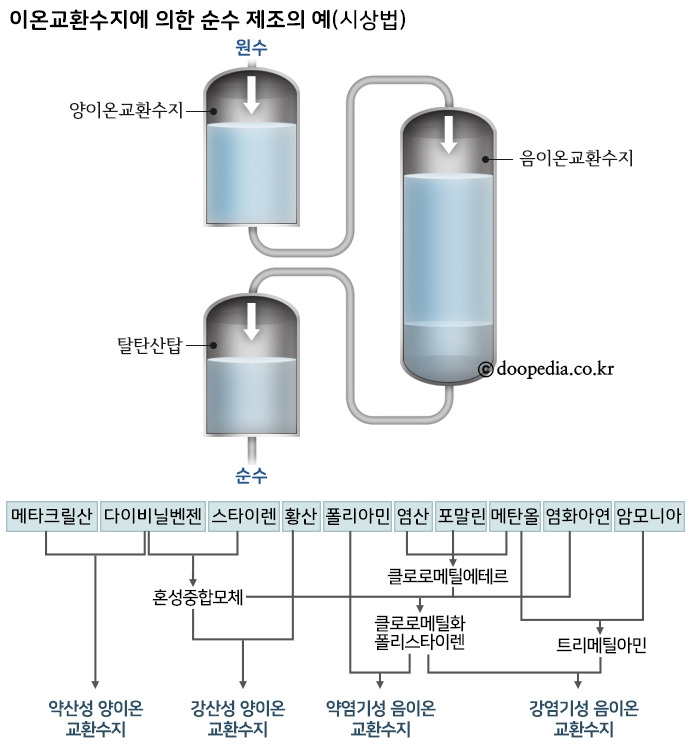
출처 두산백과
'하수 > 화학적 처리' 카테고리의 다른 글
| [부상 분리법] (0) | 2024.10.18 |
|---|---|
| [화학적 인 제거] (0) | 2024.10.18 |
| [정석탈인법] (0) | 2024.10.18 |
| [응집제첨가활성슬러지법] (0) | 2024.10.18 |
| [MAP] 화학적 인 회수 공법 (0) | 2024.10.18 |